A cristalografia é o ramo da ciência que estuda as
propriedade dos cristais, a sua formação e interacção com os factores físicos e
químicos, incluindo os ambientais.
Os cristais, devido às simetrias geradas pela
repetição espacial da sua estrutura atómica, assumem formas geométricas bem
definidas que estão na base da sua classificação: em função do número de
cadeias, dos eixos de simetria e do número e características morfológicas das
faces, são agrupados em sistemas de classificação que servem para os
identificar. Para uma descrição destas formas de classificação veja o artigo:
Estrutura cristalina
Um cristal é um sólido no qual os constituintes, sejam eles
átomos, moléculas ou íons, estão organizados num padrão tridimensional bem
definido, que se repete no espaço, formando uma estrutura com uma geometria
específica.
Em química e mineralogia, um cristal é uma forma da matéria
na qual as partículas constituintes estão agregadas regularmente, criando uma
estrutura cristalina que se manifesta macroscopicamente por assumir a forma
externa de um sólido de faces planas regularmente arranjadas, em geral com
elevado grau de simetria tridimensional.
Cristal deriva da palavra em grego antigo: κρύσταλλος
(krustallos) que quer dizer ao mesmo tempo "gelo" e
"quartzo"

Cristais e vidros
Embora o termo cristal tenha um significado preciso no
âmbito da ciência dos materiais e da física do estado sólido, em linguagem
coloquial o termo é utilizado de forma muito abrangente para designar objectos
sólidos que apresentam características de brilho e forma bem marcados, em geral
associados a formas geométricas simples. Se alguns são cristais, como o gelo, a
neve e o sal de cozinha, outros são na realidade vítreos, isto é são compostos
por materiais cujos átomos não apresentam qualquer ordenação especifica.
Apesar de em geral o arrefecimento de uma substância
conduzir à formação de cristais (isto é à cristalização), tal não é uma verdade
universal. Misturas de substâncias muito heterogéneas raramente cristalizam e
em alguns casos o arrefecimento pode ser tão rápido que as moléculas ou átomos
perdem mobilidade antes de poderem atingir a posição correcta na malha
cristalina. Um material não cristalino, como o vulgar vidro, não apresenta
ordenação espacial dos seus átomos ou moléculas ao longo de distâncias
consideráveis, face ao raio desses átomos ou moléculas, pelo que é denominado
amorfo ou vítreo. Estes materiais são em geral denominados sólidos amorfos,
sendo um exemplo geológico conhecido a obsidiana.
Na linguagem corrente e no comércio, a palavra cristal é
utilizada para designar vidros de elevada transparência e qualidade,
genericamente comercializados como cristais. Estes cristais de vidro não são mais
do que vidro com um elevado teor de óxido de chumbo, os quais, como vidros que
são, não têm estrutura cristalina, já que neles os átomos não apresentam
qualquer forma de arranjo regular. Tais vidros, apesar de denomiandos cristais,
não podem de forma alguma ser considerados um cristal no sentido utilizado no
presente texto.
Estrutura e formação dos cristais
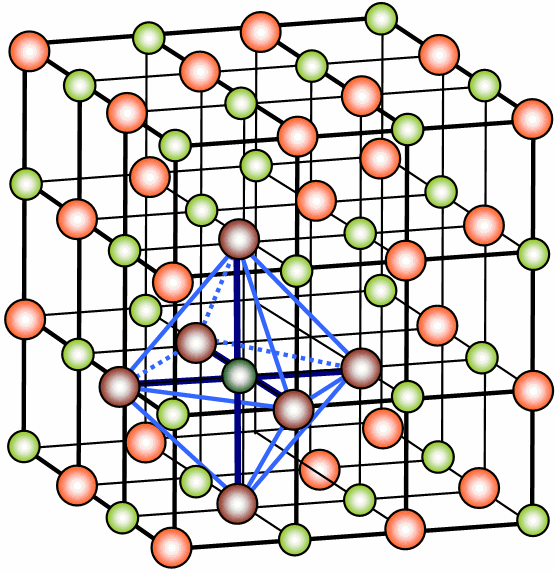
Célula unitária da estrutura de um cristal de sal (NaCl).
Note-se a ordenação dos átomos.
Num cristal a posição de cada um dos átomos, moléculas ou
iões que o constituem, que para economia discursiva passaremos a designar (de
forma menos correcta) por partículas, é determinada pelas posições ocupadas já
existentes. Assim, no momento de cristalização, a partícula forma com as suas
vizinhas um conjunto de ligações químicas (de qualquer tipo, indo das iónicas
às ligações fracas) que determina a posição espacial que tenderá a ocupar.
Em resultado desse processo, forma-se uma estrutura
tridimensional, mantida de forma mais ou menos rígida pelas ligações entre
partículas, que se vai progressivamente propagando no espaço, formado assim um
sólido que tenderá, pela expressão macroscópica desta ordenação interna, a ter
uma forte tendência para a simetria. São esses os sólidos a que chamamos
cristais.
As estruturas cristalinas ocorrem em todos os tipos de
materiais com todo o tipo de ligações inter-moleculares e inter-atómicas.
Quase todos as ligações metálicas por nuvem de electrões
coexistem com um estado policristalino, já que os metais em estado amorfo ou
monocristalino raramente existem na natureza. A generalidade dos sais
cristaliza, já que as ligações iónicas, formadas a partir da condensação de
soluções, ou da solidificação de sais em fusão, formam malhas cristalinas muito
estáveis. Daí que quase todos os sais em estado sólido sejam cristais. As
ligações covalentes também são muito comuns em cristais, em particular em
cristais orgânicos (como os açucares e as proteínas puras). Outro exemplo de
cristais com ligações covalentes são o diamante e a grafite. Os polímeros em
geral apresentam regiões cristalinas, mas o comprimento das cadeias dificulta a
cristalização total. Para além as ligações atrás referidas, as forças de van
der Waals assumem um importante papel na formação dos cristais, controlando a
aproximação das moléculas e mantendo-as nos seus mínimos energéticos.
Em geral, os cristais formam-se a partir de substâncias
fluidas à medida que estas vão sofrendo solidificação ou precipitação (caso se
trate de uma solução). A forma mais comum de cristalização consiste na
existência de uma solução, a partir da qual o material que forma o cristal vai
precipitando e, no processo, cada átomo ou molécula vai assumindo uma posição
que é determinada pelos átomos ou moléculas vizinhas.
O Gálio é um metal que forma grandes cristais.
A arrumação das partículas, e a sua persistência no lugar
que ocupam na malha cristalina, é determinada pelo existência de um mínimo
energético nessa posição, correspondente à otimização das ligações formadas
entre as partículas.
Um exemplo típico deste processo é a formação de gelo:
quando o movimento browniano induzido pela calor é suficientemente pequeno para
permitir que as moléculas de água se liguem de forma estável (em água pura aos
0º C), as ligações entre as zonas de polarização eléctrica positiva e negativa
das moléculas são imobilizadas por ligações de van der Waals (assim denominadas
em homenagem a Johannes Diderik van der Waals), as quais as mantêm em posição.
Em resultado, as moléculas da água vão sendo progressivamente presas na
estrutura, formando-se o gelo. Devido à formação desta rede, e à redução de
entropia que corresponde à ordenação das moléculas, o gelo tem uma energia
interna inferior à da água, daí que seja necessário fornecer um calor de fusão
(igual àquele que ele liberta quando solidifica) para o transformar novamente
em água.

Um cristal policromo de Bismuto.
É este calor de fusão que explica a estabilidade dos
cristais e a tendência das substâncias puras, quando arrefecem, para assumir a
forma cristalina (com elevada ordenação espacial).
Os materiais que quando solidificam não libertam um calor de
fusão, como acontece com a solidificação de um vidro, apesar de em geral serem
considerados sólidos, são, do ponto de vista termodinâmico, líquidos com
viscosidade quase infinita, já que as suas partículas não atingiram um estado
de mínimo energético.
Outra forma comum de cristalização, e a mais frequente em
geologia, já que está presente nos magmas e nas soluções hidrotermais, é a
precipitação a partir de uma solução. Um exemplo comum é o que acontece com as
soluções sobressaturadas de sal comum (cloreto de sódio): quando a quantidade
de sal em solução excede a que pode ser mantida àquela temperatura, os iões de
Sódio e Potássio começam a agregar-se de forma estruturada (em geral em torno
de impurezas ou de um cristal semente), crescendo rapidamente por remoção de
sal da solução. O mesmo acontece com a formação dos cristais no magma: a partir
do material fundido vão sendo precipitados cristais que crescem por agregação
dos átomos que os constituem.
Embora menos comum, mas de forma alguma rara, é a formação
de cristais a partir de um gás ou mistura gasosa. O exemplo mais comum é o
crescimento dos cristais de neve na atmosfera por ressublimação, ou sublimação
regressiva, ao ocorrer a passagem de vapor de água (um gás) directamente para
sólido. O mesmo acontece com a formação de cristais de enxofre nas sulfataras e
de outros cristais em torno das fumarolas.

Um policristal de quartzo, uma das substâncias cristalinas mais
comuns na Terra.
Em condições ideais, o resultado dos processos de
cristalização seria a formação de um único cristal, no qual todos os átomos (ou
moléculas) encontrassem o seu lugar numa malha cristalina comum. Na realidade,
porque o processo se inicia em múltiplos lugares e é instável no seu
desenvolvimento, forma-se em geral uma miríade de cristais que se vão fundindo
(com as óbvias imperfeições daí resultantes), à medida que as suas superfícies
de crescimento se interceptam. Os sólidos policristalinos assim formados,
apesar de localmente manterem a simetria imposta pela malha cristalina, assumem
formas complexas onde a simetria geral pode não ser imediatamente perceptível
ou mesmo não existir.
Através de processos de deposição controlada, é possível crescer
grandes monocristais, como por exemplo os necessários para aplicações
fotoeléctricas. Devido às suas especiais propriedade (e beleza) são também
criados cristais geminados, resultado de um crescimento simétrico em torno de
um eixo predefinido.

Forma dos cristais
Na natureza encontram-se cristais de formas muito
diversificadas, dependentes da forma de arranjo das cargas eléctricas nos
átomos ou moléculas que formam o cristal e das condições em que a cristalização
se deu por exemplo a água, pode assumir múltiplas formas cristalinas em função
da forma como o cristal se formou: a neve e um cubo de gelo são formas
completamente distintas de cristais de água, com estrutura diferenciada em função
das condições de cristalização.
Pelas razões atrás apontadas, a forma dos cristais depende
não só das características do material de que o cristal é formado mas também
das condições de formação (um caso extremo é o Carbono: a altas pressões e
temperaturas forma o diamante, a altas temperaturas e baixas pressões forma
grafite, substâncias que á primeira vista nada têm em comum).
Propriedades dos cristais
Um monocristal artificial de grandes dimensões crescido por
Saint-Gobain para o laser de de alta potência do Commissariat à l'Énergie
Atomique.
Os cristais apresentam propriedade ópticas e eléctricas
específicas distintas das de quaisquer outros sólidos ou fluidos, o que os
torna extremamente úteis em aplicações electro-ópticas e electrónicas, as quais
dependem da sua estrutura, do tipo de ligações e das impurezas e defeitos na
malha cristalina de que eventualmente padeçam.
A maior parte dos materiais apresenta defeitos na sua malha
cristalina, em geral resultantes da presenças de átomos ou moléculas de outras
substâncias ou de defeitos no posicionamento da malha durante a cristalização.
Estes defeitos conferem características particulares aos cristais, estando na
base de muitas tecnologias. São defeitos na malha cristalina do Silício,
induzidas, por exemplo, pela presença átomos de Germânio ou Gálio, que permitem
o aparecimento de semicondutores, a base da actual tecnologia electrónica.
Os efeitos mais conhecidos da estrutura cristalina são os
piezoeléctricos, que estão na base, entre outras coisas, dos relógios de
quartzo e das balanças electrónicas, os ferroeléctricos, utilizados em
detectores diversos, o efeito piroeléctrico, usado em detectores de calor, termómetros
e detectores de intrusão, e, acima de tudo, a formação de semicondutores, os
quais estão na base de toda a electrónica dos transístores e díodos aos
computadores.
Outras propriedades dos cristais estão a levar à utilização
tecnológica da supercondutividade a altas temperaturas e a crescentes
desenvolvimentos no campo da física da matéria condensada que poderão abrir
novas áreas tecnológicas.
O comportamento óptico dos cristais está na base do laser,
do maser, das câmaras fotográficas e de filmar digitais, dos díodos emissores
de luz (LED’s) e de todos os desenvolvimentos em matéria de fotoelectrónica que
estão a revolucionar o mundo tecnológico.
O pleocroísmo exibido por muitos cristais abre novas
perspectivas em termos de óptica e da sua utilização em técnicas analíticas.

Sem comentários:
Enviar um comentário